
比疫苗更可贵的是信心与承诺!

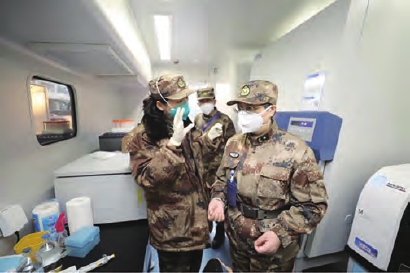
陈薇院士团队在进行新冠病毒疫苗研究。
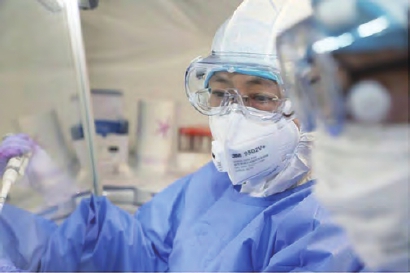
中国疫苗已经做了安全、有效、质量可控、可大规模生产的前期准备工作。
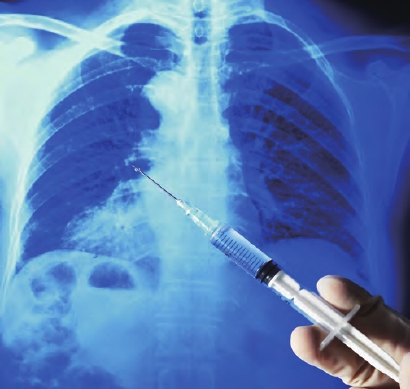
第一位参加临床试验者3月16日接种。
根据世卫组织早前发布的消息,目前没有证据表明新冠病毒会在夏季消失,世界各国仍需积极防控,同时抓紧时间研发疫苗。
记者|陈 冰
由军事科学院军事医学研究院陈薇院士领衔的科研团队自抵达武汉以来,就集中力量展开在疫苗研制方面的应急科研攻关,3月16日20时18分,陈薇院士团队研制的重组新冠疫苗获批启动展开临床试验。
世界是平的。在新冠肺炎疫情面前,没有一个国家能够独善其身。
在疫情快速蔓延的当下,全世界都在紧盯着一件事:新冠病毒疫苗何时能够研发并生产出来?
殊途同归的目标
根据世卫组织早前发布的消息,目前没有证据表明新冠病毒会在夏季消失,世界各国仍需积极防控,同时抓紧时间研发疫苗。全球目前共有20多种新冠肺炎疫苗正在研发阶段,一些治疗方法正在进行临床试验,预计于几周内获得首批结果。
自1月26日抵达武汉以来,陈薇院士团队联合地方优势企业,在埃博拉疫苗成功研发的经验基础上,争分夺秒开展重组新型冠状病毒疫苗的药学、药效学、药理毒理等研究,快速完成了新冠疫苗设计、重组毒种构建和GMP条件下生产制备,以及第三方疫苗安全性、有效性评价和质量复核。16日晚上,陈薇院士团队研制的新冠疫苗通过了临床研究注册审评,获批进入临床试验。
中国工程院院士、军事科学院军事医学研究院研究员陈薇在接受总台央视记者独家采访时介绍,按照国际的规范,国内的法规,疫苗已经做了安全、有效、质量可控、可大规模生产的前期准备工作。
3月5日,美国生物技术公司莫德纳(Moderna)宣称,美国食品药品监督管理局(FDA)已完成对该公司研制的新型冠状病毒疫苗“mRNA-1273”的审查,批准其进入临床试验。莫德纳公司最初预计,mRNA疫苗的研发可能需要三个半月以上。不过,42天以后,上百人的研发组竟然实现了突破。莫德纳公司首席技术运营和质量官胡安·安德烈斯表示,这是“创纪录的速度”。
所谓mRNA,中文称为“信使核糖核酸”。在体外合成病毒的相关序列mRNA,再将之传递到人体细胞内形成免疫记忆,即是mRNA疫苗。莫德纳公司表示,“mRNA-1273”疫苗可针对病毒的刺突蛋白发挥作用。刺突蛋白,正是新冠病毒感染宿主细胞的关键所在。
2月24日,“mRNA-1273”的第一批人体疫苗,已经运送至位于马里兰州的美国国立卫生研究院(NIH),由NIH接收,用于第一阶段临床试验。莫德纳公司招募45名健康志愿者进行药物测试,具体结果或将于7月或8月宣布。而第一位参与临床试验的人士于3月16日接种了实验疫苗。美国公共卫生健康官员说,要完全证明疫苗有效需要一年到一年半时间。
虽然美国总统特朗普一再敦促美国制药和生物技术公司尽快开发出新冠肺炎疫苗,但美国国家过敏和传染病研究所所长安东尼·福西还是在多个场合表示,“即使以火箭般的速度”,距离疫苗真正投入使用需要至少一年的时间。
《科学》杂志主编霍尔顿·索普在3月12日的社论中写道:“尽管研制疫苗所需的步骤可能变得更加高效,但其中许多步骤仍然依赖于必要的生物和化学过程。研发疫苗必须有基本的科学依据。它必须是可制造的,必须是安全的。疫苗研发需要时间,特朗普多次重复加速的要求并不会改变结果。”他讽刺说,特朗普可能也会说:“帮我个忙,加速启动曲速引擎。”但是曲速引擎只是科幻小说中的一种超光速推进系统。不切实际地要求疫苗研发加速有违科学原理。索普在文章最后请求:“总统先生,如果你想要什么,请从尊重科学及其法则开始吧。”
一个毋庸置疑的事实是,目前全世界的科学家都在快马加鞭研发新冠肺炎疫苗。
3月12日,受美国国防部资助的加拿大生物制药公司Medicago表示,在收到新型冠状病毒的基因序列20天后,他们通过一种特别的技术已经研制出一种新冠病毒疫苗。他们希望尽快将这种疫苗提交给美国生物制品评价和研究中心。该公司CEO布鲁斯·克拉克称,公司每月可生产1000万剂疫苗。他还表示,如果监管审批通过,疫苗将最快于11月上市。
Medicago并不是第一个宣布找到治愈新冠肺炎路径的公司。克拉克甚至称该公司的技术更可靠更适宜推广,他提到公司此前为季节性流感研发的疫苗就被证实很有效。“有一些公司声称他们也在研发新冠肺炎疫苗。但是他们采用的是完全不同的技术。希望他们能成功。”
在中国,3月16日,上海市科委主任张全在上海市政府新闻发布会上表示,多路线部署推进的疫苗研发都已取得良好进展。mRNA(信使RNA)疫苗,已启动灵长类动物毒理和药效预实验,预计4月中旬临床试验;病毒样颗粒(VLP)疫苗,小鼠免疫实验已产生特异性抗体。可见,各国各机构采用各种办法,殊途同归,目标都在获得实现针对新冠病毒的疫苗。
资金和安全的考量
在此之前,人们将目光投向了那些“最有能力的企业”。来自英国的葛兰素史克、法国的赛诺菲、美国的默沙东与辉瑞被称为世界四大疫苗巨头,它们牢牢掌控着全球最畅销的疫苗产品。
2月初,葛兰素史克宣布与流行病防范创新联盟(CEPI)合作,以加快研制新冠病毒疫苗,为其提供在H1N1流感疫情中被证明有效的“佐剂”技术——用于提高机体保护能力,同时又能减少免疫物质的用量,降低疫苗的生产成本。此后,中国三叶草生物制药公司宣布与葛兰素史克达成合作,后者为其提供“佐剂”。
2月中旬,赛诺菲宣布,会利用先前开发SARS疫苗的经验与美国生物医学高级研究与开发局合作,利用先进的基因重组技术平台加速开发新冠病毒疫苗。赛诺菲执行副总裁洛伊在一次电话会议上表示,他估计可以在“不到六个月的时间里”获得候选疫苗,有可能在“一年至一年半的时间里进入临床试验”。另据英国路透社3月5日报道,辉瑞正在考虑与德国公司合作研发疫苗。
“研发疫苗需要巨大的资金支出。”德国柏林夏里特医学院传染病研究学者瓦尔朗德说,在这次新冠肺炎疫情中,大型制药企业并没有争相投资研发,因为风险太高。目前正在参与相关工作的公司背后也有政治推动。作为一家成立9年的企业,莫德纳一直在亏损,且没有任何产品出售。无法独自承担开发全新疫苗成本的莫德纳,在获得流行病防范创新联盟的资助后,一旦研发成功需要量产,很可能就要与大型制造商签订协议。
然而大型制造商是什么态度呢?葛兰素史克健康部门总监托马斯·布洛伊尔近日接受媒体采访时表示,疫苗研发通常需要8至10年时间,不过近年来由于技术发展,一些公司能在3个月内生产出一种疫苗,但测试和审批阶段仍需要很多时间,在最顺利的情况下,也至少需要12至18个月。葛兰素史克之所以仅提供辅助性技术,是因为很难预测新病毒的中长期暴发状况。他强调,“疫苗生产只有大规模地推进才是值得的”。
英国《卫报》称,在过去20年里,世界暴发了“非典”、中东呼吸综合征、寨卡、埃博拉等流行病疫情。然而,目前只有针对埃博拉的疫苗研发出来,流行疾病疫苗研发大概率随着疫情消散而停滞。据BBC介绍,默沙东生产的埃博拉疫苗2015年首次在几内亚使用,但当时该疫苗并未拿到药物执照,只是在该国被允许“同情用药”——在没有其他治疗方法的情况下,使用一种新的、未经批准的药来应对严重疾病。直到去年,这个疫苗才获得美国监管部门批准使用。另一种强生公司开发的埃博拉疫苗去年才在刚果民主共和国使用。由此可见,此次新冠肺炎疫苗到底能够以多快的速度冲刺,实在是前途未卜。
虽然大家都清楚,一个安全有效的疫苗最终获准上市至少需要约1年的时间。可是对于新冠病毒这样一个病死率可能为2%的传染病来说,一年的等待就意味着会有更多的人死亡。这也就产生了另外一个让人担忧的问题,大家会不会为了速度而放松对安全的要求。
美国国家科学院院士、哈佛大学公共卫生研究教授巴里布卢姆(Barry Bloom)指出,疫苗从定义上就决定了它会被用于健康人群,所以疫苗的研发就应该更加小心。他说:“从技术上来讲,由于疫苗研发科技的发展,我们拿到一段DNA序列之后,只需要花数天到数周的时间就可以得到了一个潜在的候选疫苗,这在全球历史上绝无仅有。但并不是所有候选疫苗都对人具有保护性和免疫效应,所以需要先在小鼠或其他动物模型上验证测试,而这需要时间。因为最终需要把疫苗用在健康受试者身上,所以我们不能急于跨过这一步,不能因为事件紧急就迅速把疫苗注射在人身上,然后造成更多的伤害,而非保护。
“所以第二步要做的是我们需要在多种测试条件和剂量下测试多种候选疫苗,来评估用哪些抗原组合可以在人体内产生最佳的免疫保护效应。制药和疫苗研发产业的所有人都明白,我们可以治愈小鼠身上的所有疾病,但换到人身上未必起效,因此必须要开展人体临床试验。”
巴里布卢姆认为,在危机来临或已经穷尽手段的情况下,可能存在豁免一些药物审批程序,并允许病人自愿试用在研药物的可能性。但是有一种情况是:人们第一次感染登革热后产生的抗体不仅对第二次感染登革热没有保护作用,反而会加速感染、引发高危型登革热。有7篇关于其他冠状病毒的文献指出,免疫增强疗法(immune enhancement)可能会使部分患者的病情恶化。所以,必须非常严肃谨慎地处理疫苗安全性这个议题。
辉瑞呼吁共同抗疫
3月13日,辉瑞公司呼吁生物制药行业通过空前的协同合作共同抗击 COVID-19(新冠病毒)。辉瑞董事长兼 CEO艾伯乐博士指出:“在最近这段令人不安的日子里,辉瑞一直在竭尽全力积极应对COVID-19疫情。包括辉瑞在内的很多公司正在研发抗病毒药物,以帮助被感染的患者抵御新冠病毒,并研制新的疫苗以预防感染、遏制这种疾病的进一步传播。辉瑞正在持续推进潜在抗病毒药物的研发进程,并与BioNTech 合作进行某一种潜在 mRNA 冠状病毒疫苗的研制工作。我们作为整个行业的一个团队,利用我们的科学知识、专业技能和生产能力,切实应对这场日益严峻的危机。”
为此,辉瑞做出五项承诺,以帮助科研人员更快研发相关的药物和疫苗,保护人类早日摆脱这场不断蔓延的疫情,让医药行业更好地应对未来的全球健康危机。这五项承诺包括——
分享工具和见解。目前对新冠病毒所知甚少,很多公司正致力于细胞检测、病毒筛选、血清学检测和转译模型,以测试潜在的药物和疫苗。辉瑞承诺在一个开放的资源平台上向广泛的科研团体共享一些现有的重要工具,并实时分享从其他公司获得的数据和知识,从而加快为病人提供药物和疫苗。
整合人员。辉瑞认为,人力资本是最宝贵的资源。为此已组建一支SWAT 团队,汇集了卓越的病毒学家、生物学家、化学家、临床医生、流行病学家、疫苗专家、制药科学家和其他重要专家,集中精力应对这次疫情。这支团队正在投入他们的工作热情、使命感和专业知识,专注于加快科研与开发进程,力争尽快向患者提供亟需的药物和疫苗。
运用药物研发优势。很多较小规模的生物技术公司正在筛选一些化合物或现有的药物,以抑制COVID-19病毒的活性,但有些缺乏研发阶段后期和驾驭复杂监管体系方面的相关经验。辉瑞承诺分享在临床研发和监管方面的经验,为这些公司提出的、最具前景的候选药物提供支持。
提供生产能力。一旦某种药物和疫苗获得批准,就需要在全世界快速扩大生产和部署, 以终结这场疫情。辉瑞作为疫苗和药物的最大生产商之一,承诺利用各种过剩的产能,并有可能转变生产配置,切实支持其他公司尽快实现可拯救千百万生命的重大医学突破,尽快造福于广大患者。
完善快速响应机制。为应对今后的全球健康威胁,辉瑞正在联络一些美国的联邦机构,包括国家卫生研究院(NIH)、国立过敏和传染病研究院(NIAID)和疾控中心(CDC),组建一支由科学家、临床医生和技术人员组成的跨行业快速响应团队,一旦今后出现疫情就可立即采取行动。
艾伯乐说:“辉瑞呼吁创新生态系统中的全体成员——从大型制药公司到小规模的生物技术公司,从政府机构到学术机构——携手合作,共同应对这次严峻的危机。我们相信,在我们的共同努力下,没有任何健康挑战是我们不可战胜的。”

 放大
放大 上一版
上一版