
科学家试图找出“永生”秘密

中国科学院分子细胞科学卓越创新中心,科研人员在切割涡虫 本报记者 陶磊 摄

科研人员在做实验

扫码看视频
金秋十月,属于科学的年度高光时刻。今年的诺贝尔生理学或医学奖获得者,从“停止生长”的线虫出发,在微小RNA领域作出突破性贡献。线虫,也让数位科学家摘得诺奖桂冠。线虫有个“好兄弟”涡虫,和诺奖也有千丝万缕联系,还是地表“最强再生之王”,纵是“千刀万剐”,身体碎片也能再生出结构完整的个体。正是因为强大再生能力,正常饲养的涡虫几乎被认为是“永生”的。
秋日午后,记者跟随中国科学院分子细胞科学卓越创新中心研究员曾安,走进“再生实验室”。这里培育的数十万条涡虫,“祖先”都是曾安2019年回国时带回的第一条涡虫。涡虫的强大再生能力从何而来?涡虫如何感知自己丢失了哪部分的组织并完美再生?我们是否有可能将这种再生能力运用到人体中?在“再生实验室”,科研人员正努力破解这些奥秘。
碎片再生完整个体
传统动物分类学上,涡虫隶属于扁形动物门涡虫纲,广泛分布于世界各地。19世纪,美国发育学家哈丽特·伦道夫注意到了涡虫的强大再生能力。他发现经过切割的涡虫,身体每一部分竟都能重新发育为一个完整的个体。现代“遗传学之父”托马斯·摩尔根也对涡虫再生开展了近十年的研究,他将一只涡虫“千刀万剐”成了279个碎片,惊讶地发现涡虫的一些身体碎片依然能重新再生出结构完整的个体。
“然而,在发表了数篇论文后,摩尔根发现当时的技术手段无法深入地窥见再生的机理,于是转而研究果蝇,发现了染色体是生物性状遗传的本质,开启了遗传学的世纪。”曾安介绍。
他告诉记者,20世纪遗传学兴起后,凭借在研究基因调控机制方面的便利,以果蝇为代表的模式生物日渐“得宠”;而涡虫领域的研究者们由于缺乏遗传学手段,无法将研究深入到分子水平,无奈停下了脚步。转机出现在20世纪末,RNA干扰技术出现,曾安的博士后导师桑切斯教授将其引入了涡虫再生领域,并首次筛选了一些演化上保守的基因在涡虫发育再生过程中的功能,开创了涡虫再生研究的遗传学时代。“同样是在线虫中发现的RNA干扰技术,在2006年得到了诺贝尔生理学或医学奖的青睐。”曾安补充说。2006年,曾安一头扎进涡虫的广阔天地。他发现,已知的“再生本领”里,无论是小鼠的视网膜神经节再生、线虫的运动神经元轴突再生,还是斑马鱼心肌细胞修复损失器官,都无法与堪称“逆天改命”的涡虫相提并论。
他坚定地在利用分子手段解析再生原理的研究道路上走下去。2019年秋回国后,加入中国科学院分子细胞卓越中心带领研究组继续攻关涡虫再生。
多能干细胞是“开关”
显微镜灯光的照射下,曾安手持切割刀片,小心翼翼地把一条2厘米长的涡虫切割成数片,7天后,这些“碎片”就将长成全新的个体。
上海已入秋。走进恒温20摄氏度的涡虫培养房,倒也不觉清凉。亮堂的培养房里,整齐摆放着数十所“涡居”,好多涡虫贴在生化培养箱的壁沿上。凑近瞧,涡虫背腹扁平,像一片小柳树叶,身体是黑褐色的,背面深,腹面则略浅;头的背面有两个黑色的眼点,而在腹面后约三分之一处,是涡虫的口。“它们吃小牛的牛肝,一小块牛肝就够实验室里涡虫的全部口粮了。”正在喂食的研究生说。
曾安介绍,涡虫是少数几种在胚胎发生后,仍能维持体内多能干细胞的生物之一。这个多能干细胞群能不断分化成所有三胚层来源的细胞类型,用于生长、再生和替换凋亡细胞。
“当涡虫受到损伤后,多能干细胞会迅速响应并迁移至受损部位,启动分化进程,诱导新芽基产生。一周内,受损的涡虫就能重新长出新的神经、排泄、消化和生殖系统,甚至是整个大脑。”曾安告诉记者。
那么,成体多能干细胞是如何受到调控并起始分化成不同细胞类型的?这种多能性调控和组织器官再生机制之间的联系究竟是什么?在前期研究中,曾安领衔的研究组运用单细胞转录组测序技术鉴定并分离了涡虫中成体多能干细胞类群,并找到其分子标记TSPAN-1。科研人员把TSPAN-1+的单细胞移植到致死剂量照射后的涡虫体内,可以重建整个涡虫三胚层来源的所有组织和器官,显示TSPAN-1+细胞是其体内成体多能干细胞。这个工作发表四年后就进了美国大学生的教科书。
“我们近期的工作聚焦在涡虫细胞如何感知自身空间位置信息。类比到人身上,就是组织损伤后如何恢复原来器官的形态和空间位置。”曾安表示。
“返老还童”或能实现
人体大部分组织或器官中都有干细胞的身影,它们参与组织内损伤细胞的更新和替换。
涡虫中,接近85%的基因与人类高度同源。不过与拥有“不死之身”的涡虫相比,人类只有少数器官具有非常有限的修复能力,并且这种能力还会随着年龄的增长而削弱。
“研究涡虫再生过程的分子机制,揭示不同细胞如何帮助动物再生受损组织,有利于我们理解为什么高等生物丢失了这种能力。”曾安说。
同样有趣的是,涡虫除了“砍不死”,还“饿不死”——可以长期抵抗饥饿,并根据营养状况“自主切换”生长和去生长。曾安研究组成员说,当食物充足时,涡虫会一直生长到它们的最大体型;但在饥饿状态下,涡虫会通过缩小体积来维持自身稳态,饥饿数月后,一只完全成熟的2厘米涡虫,会收缩至1毫米甚至更小。
“这种长期抵抗饥饿的本领同样值得深入探究,‘去生长’很可能是逆转衰老的方式之一。”曾安表示,若能揭示这一调控机制并加以运用,古人靠炼制仙丹追求的“返老还童”或许可以靠小小涡虫来实现。
记者了解到,由于对涡虫再生的研究非常基础,属于冷门学科,产出的成果短时间内无法和转化挂上钩,因此国内开展涡虫研究的实验室和经费都非常有限,“研究涡虫,很多工具都要DIY!”幸运的是,中国科学院分子细胞卓越中心给了曾安“定心丸”,让他和研究组甘坐“冷板凳”,敢啃“硬骨头”,面向人民生命健康,真正做一些从零到一的原创科学成果。“涡虫的再生和衰老这些基础的科学问题,可以帮助我们了解所有的物种,包括人类自己。”曾安总结说,我们对于人类自身的好奇和治疗疾病的努力,或许在此刻的自然界中都已有了答案。 本报记者 郜阳

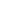 放大
放大 上一版
上一版